
Es uno de los sonidos distintivos del verano: el ruido de las personas que tocan la parte superior de sus latas de bebida gaseosa antes de abrirlas. ¿Pero este ritual generalizado realmente impide que una lata de cerveza o pop se derrame?
Cuando abre una lata de bebida gaseosa, el refrescante "silbido" es el resultado de burbujas de gas que escapan del líquido como resultado de un cambio en la solubilidad del dióxido de carbono (CO2) en él. Este cambio ocurre debido a la presión dentro de la lata disminuyendo desde ~ Barra 3 (puede cerrarse) a la barra 1 a presión atmosférica (puede abrirse). La solubilidad de CO2 en agua se reduce de ~ 4.5g en un litro de agua en ~ 3 bar, a ~ 1.5g a presión atmosférica, algo que se describe por La ley de Henry.
Antes de que se abra la lata, las burbujas microscópicas de gas se adhieren al interior (nucleación). Cuando se abre la lata, estas burbujas aumentan de tamaño debido a la disminución de la solubilidad de CO2. Cuando estas burbujas alcanzan un cierto tamaño, se desprenden del interior de la lata y se elevan hasta la parte superior de la lata debido a la flotabilidad y desplazan el líquido en su camino.
Entonces, ¿qué parte podría tocar la parte superior de la puede jugar en este proceso? Si esta técnica realmente funciona o no es el tema de debate, pero hay una teoría que explica por qué puede funcionar. Como se describió anteriormente, las burbujas en un recipiente sin abrir se pueden nuclear en las paredes (Figura 2a), por lo que golpear la lata antes de abrir podría desalojar algunas de las burbujas, lo que les permitiría flotar hasta la parte superior del líquido.
Cuando se abre una lata, las burbujas se expanden con las más profundas dentro del líquido que viajan más allá de las que están cerca de la superficie, desplazando más de la bebida y posiblemente dando como resultado mayores cantidades de líquido expulsado. Una lata "golpeada" tendrá menos de estas burbujas "profundas" y por lo tanto, se desalojará menos líquido, y posiblemente se pulverizará, que una lata "sin explotar".
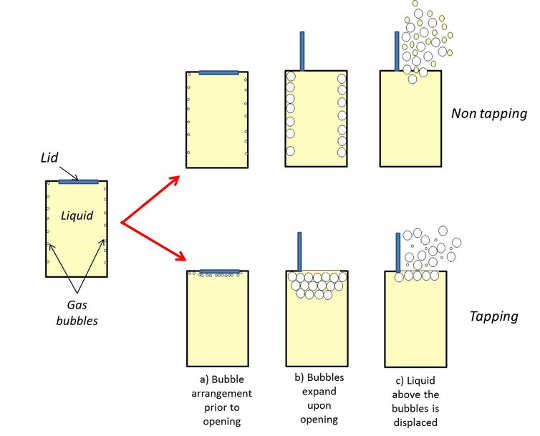 Figura 2: un posible mecanismo de por qué tocar una lata antes de abrirla puede reducir la efusión. Diagrama dibujado específicamente para este artículoLas burbujas también se pueden desprender desde el lado de la lata con sacudidas violentas, por supuesto, pero este método introduce más turbulencias que aumentan la energía del sistema, lo que genera más burbujas en la bebida y más rociado cuando se abre. Golpear bruscamente la parte superior de una botella de cerveza abierta con otra tiene un efecto similar, que comúnmente resulta en una chorro colosal de espuma de cerveza. Esto se debe a que las ondas de presión causadas por el impacto crean pequeñas "nubes setas"Dentro de la botella que expulsan grandes cantidades de líquido mientras escapan".
Figura 2: un posible mecanismo de por qué tocar una lata antes de abrirla puede reducir la efusión. Diagrama dibujado específicamente para este artículoLas burbujas también se pueden desprender desde el lado de la lata con sacudidas violentas, por supuesto, pero este método introduce más turbulencias que aumentan la energía del sistema, lo que genera más burbujas en la bebida y más rociado cuando se abre. Golpear bruscamente la parte superior de una botella de cerveza abierta con otra tiene un efecto similar, que comúnmente resulta en una chorro colosal de espuma de cerveza. Esto se debe a que las ondas de presión causadas por el impacto crean pequeñas "nubes setas"Dentro de la botella que expulsan grandes cantidades de líquido mientras escapan".
Vidrio y efusivo
El debate de tocar a un lado, el material real del que está hecho el contenedor también puede reducir la efusión. Se ha demostrado que la cantidad de espuma que se forma al verter cerveza en vasos de diferentes "humectabilidades" (la medida en que el agua humedece un material) puede afectar no solo la cantidad de cabeza de cerveza formada, sino también el tamaño de las burbujas en el interior del vaso. Esta información es relevante cuando se piensa que tales burbujas son la causa de las inundaciones.
Otro factor importante cuando se trata del nivel de efusión es la estabilización de las burbujas causada por la presencia de moléculas grandes en la bebida. Esta es la razón por la cual algunas cervezas tienen cabezas de espuma de larga vida en comparación con las burbujas de vida corta en la superficie de, digamos, agua con gas. Pero tales agentes estabilizadores de espuma son una conversación para otro día.
Así que este verano, por qué no probar diferentes formas de abrir su bebida gaseosa, y ver cuánto de ella terminas usando.
Sobre el Autor
Chris Hamlett, profesor de Química, Universidad de Nottingham Trent
Este artículo se publicó originalmente el La conversación. Leer el articulo original.
Libros relacionados
at InnerSelf Market y Amazon

























