Los científicos han utilizado una "interfaz cerebro-espina" inalámbrica para eludir las lesiones de la médula espinal en un par de macacos rhesus, restaurando el movimiento intencional de caminar a una pierna temporalmente paralizada.
Los investigadores dicen que esta es la primera vez que se usa una prótesis neuronal para restaurar el movimiento de caminar directamente a las piernas de los primates no humanos.
"El sistema que hemos desarrollado utiliza señales registradas en la corteza motora del cerebro para activar la estimulación eléctrica coordinada de los nervios en la columna vertebral que son responsables de la locomoción", dice David Borton, profesor asistente de ingeniería en la Universidad de Brown y coautor principal de El estudio. "Con el sistema encendido, los animales de nuestro estudio tenían una locomoción casi normal".
El trabajo podría ayudar a desarrollar un sistema similar diseñado para humanos que han tenido lesiones en la médula espinal.
Restablecer la comunicación
"Hay evidencia para sugerir que un sistema de estimulación espinal controlado por el cerebro puede mejorar la rehabilitación después de una lesión de la médula espinal", dice Borton. "Este es un paso para probar más esa posibilidad".
Grégoire Courtine, profesor de la Ecole Polytechnique Federale Lausanne (EPFL) que dirigió la colaboración, ha iniciado ensayos clínicos en Suiza para probar la parte de la espina dorsal de la interfaz. Advierte: "Hay muchos desafíos por delante y pueden pasar varios años antes de que todos los componentes de esta intervención puedan probarse en las personas".
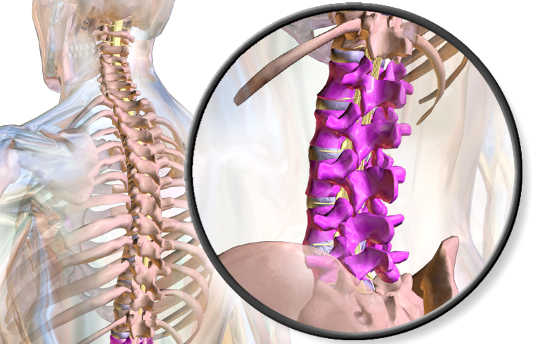
Caminar es posible debido a una interacción compleja entre las neuronas del cerebro y la médula espinal. Las señales eléctricas que se originan en la corteza motora del cerebro viajan hasta la región lumbar en la médula espinal inferior, donde activan las neuronas motoras que coordinan el movimiento de los músculos responsables de extender y flexionar la pierna.
Una lesión en la espina dorsal superior puede cortar la comunicación entre el cerebro y la médula espinal inferior. Tanto la corteza motora como las neuronas espinales pueden ser completamente funcionales, pero no pueden coordinar su actividad. El objetivo del estudio fue restablecer parte de esa comunicación.
La interfaz cerebro-espina usa una matriz de electrodos del tamaño de una píldora implantada en el cerebro para registrar las señales de la corteza motora. La tecnología del sensor fue desarrollada en parte para uso investigativo en humanos por la colaboración BrainGate, un equipo de investigación que incluye Brown, Case Western Reserve University, Massachusetts General Hospital, Providence VA Medical Center y Stanford University.
La tecnología se está utilizando en ensayos clínicos piloto en curso, y se utilizó previamente en un estudio liderado por el neuroingeniero de Brown, Leigh Hochberg, en el que las personas con tetraplejía podían operar un brazo robótico simplemente al pensar en el movimiento de su propia mano.
Un neurosensor inalámbrico, desarrollado en el laboratorio de neuroingeniería del profesor Brown Arto Nurmikko por un equipo que incluía Borton, envía las señales reunidas por el chip cerebral a una computadora que las decodifica y las envía de forma inalámbrica a un estimulador espinal eléctrico implantado en la zona lumbar columna vertebral, debajo del área de la lesión. Esa estimulación eléctrica, entregada en patrones coordinados por el cerebro descodificado, envía señales a los nervios espinales que controlan la locomoción.
Para calibrar la decodificación de las señales cerebrales, los investigadores implantaron el sensor cerebral y el transmisor inalámbrico en macacos sanos. Las señales transmitidas por el sensor podrían entonces asignarse a los movimientos de las piernas de los animales. Mostraron que el decodificador fue capaz de predecir con precisión los estados del cerebro asociados con la extensión y la flexión de los músculos de las piernas.
La conexión inalámbrica es crucial
La capacidad de transmitir señales cerebrales de forma inalámbrica fue fundamental para este trabajo, dice Borton. Los sistemas con sensor de cerebro con cable limitan la libertad de movimiento, lo que a su vez limita la información que los investigadores pueden recopilar sobre la locomoción.
"Hacer esto de forma inalámbrica nos permite mapear la actividad neuronal en contextos normales y durante el comportamiento natural", dice Borton. "Si realmente buscamos neuroprótesis que algún día puedan implementarse para ayudar a los pacientes humanos durante las actividades de la vida cotidiana, estas tecnologías de grabación sin ataduras serán fundamentales".
Para el trabajo actual, publicado en NaturalezaLos investigadores combinaron su comprensión de cómo las señales cerebrales influyen en la locomoción con los mapas espinales, desarrollada por el laboratorio de Courtine en EPFL, que identificó los puntos neuronales de la columna responsables del control locomotor. Eso permitió al equipo identificar los circuitos neuronales que deberían ser estimulados por el implante espinal.
Con estas piezas en su lugar, los investigadores probaron el sistema completo en dos macacos con lesiones que abarcaban la mitad de la médula espinal en la columna torácica. Los macacos con este tipo de lesión generalmente recuperan el control funcional de la pierna afectada en un período de aproximadamente un mes, según los investigadores. El equipo probó su sistema en las semanas posteriores a la lesión, cuando todavía no había control volitivo sobre la pierna afectada.
Los resultados muestran que con el sistema encendido, los animales comenzaron a mover sus piernas de forma espontánea mientras caminaban en una cinta rodante. Las comparaciones cinemáticas con controles sanos mostraron que los macacos lesionados, con la ayuda de la estimulación controlada por el cerebro, podían producir patrones locomotores casi normales.
Aunque demostrar que el sistema funciona en un primate no humano es un paso importante, los investigadores enfatizaron que se debe hacer mucho más trabajo para comenzar a probar el sistema en humanos. También señalaron varias limitaciones en el estudio.
Por ejemplo, aunque el sistema utilizado en este estudio retransmitió con éxito señales del cerebro a la columna vertebral, carece de la capacidad de devolver información sensorial al cerebro. El equipo tampoco pudo evaluar la presión que los animales pudieron aplicar a la pierna afectada. Si bien estaba claro que la extremidad estaba teniendo algo de peso, no quedó claro en este trabajo cuánto.
"En un estudio de traducción completo, querríamos hacer más cuantificación sobre qué tan equilibrado está el animal al caminar y medir las fuerzas que puede aplicar", dice Borton.
A pesar de las limitaciones, la investigación establece el escenario para futuros estudios en primates y, en algún momento, potencialmente como una ayuda de rehabilitación en humanos.
"Hay un dicho en la neurociencia de que los circuitos que disparan juntos se conectan entre sí", dice Borton. "La idea aquí es que al unir el cerebro y la médula espinal, podremos mejorar el crecimiento de los circuitos durante la rehabilitación. Ese es uno de los principales objetivos de este trabajo y un objetivo de este campo en general ".
La financiación provino del Séptimo Programa Marco de la Comunidad Europea, la Beca de Inicio de la Fundación Internacional para la Investigación en Paraplejia del Consejo Europeo de Investigación, el Centro Wyss en Ginebra, Beca Marie Curie, Becas Marie Curie COFUND EPFL, Beca Medtronic Morton Cure Paralysis Fund, NanoTera.ch Programa, Centro Nacional de Competencia en Investigación en Robótica Programa Sinergia, Cooperación Científica y Tecnológica Sino-Suiza, y Fundación Nacional Suiza para la Ciencia.
Fuente: Universidad de Brown
{youtube}pDLCuCpn_iw{/youtube}
Libros relacionados:
at InnerSelf Market y Amazon
























